RAPPELS sur la catalyse
Réaction chimique et catalyse
Définition : Énergie d'activation
L'énergie d'activation est la quantité d'énergie nécessaire pour initier un processus chimique, le plus souvent une réaction. En effet, pour démarrer un processus, on doit souvent faire face à une "barrière énergétique" (c'est-à-dire apporter un minimum d'énergie pour le démarrage). Cette quantité est exprimée en kJ mol-1 (par mole de réactif).
Une explication simplifiée de cette barrière d'énergie peut être donnée par le mécanisme suivant :
Pour que deux molécules puissent réagir, il faut que leurs nuages électroniques puissent entrer en contact. Pour cela, il leur faut vaincre leur répulsion électrique. Ceci nécessite qu'elles se heurtent avec un élan suffisant et avec l'orientation adéquate. Cette énergie cinétique constitue l'énergie d'activation (représentant grossièrement l'énergie à fournir pour passer la "barrière d'énergie" à franchir dans la première partie du chemin de la réaction).
Il faut en quelque sorte d'abord fournir un "effort" pour casser les liaisons, avant d'en créer d'autres.
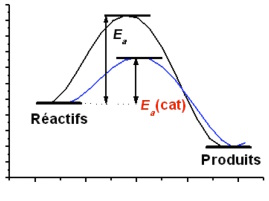
Le catalyseur diminue l'énergie d'activation
Cette énergie d'activation peut être diminuée, en utilisant un catalyseur, comme illustré ci-après.
Définition : Catalyseur
Un catalyseur est une substance qui accélère une réaction sans modifier son enthalpie libre de réaction (l'équilibre). Il vaut mieux adopter cette définition que de dire que le catalyseur accélère la
réaction sans être lui-même consommé ou modifié. Il peut en effet s'empoisonner ou vieillir.
Catalyse hétérogène
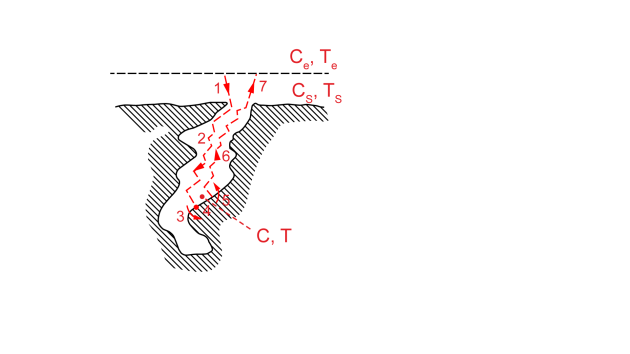
Grain de catalyseur
Le courant de fluide réactif parcourt le réacteur en passant entre les grains catalytiques. On représente ci-contre les étapes successives suivies par les molécules de réactifs pour accéder à un site catalytique actif au cœur d'un pore de grain, et pour réagir.
Ici on note \(C_e\) et \(C_s\) la concentration d'un réactif-clé à l'extérieur du grain et en surface du grain (respectivement). De façon similaire, Te et Ts sont les températures régnant à l'extérieur et en surface du grain (respectivement).
De même, d'un point de vue thermique, la réaction a lieu dans les pores du grain, où la température va augmenter (si la réaction est exothermique), puis ce flux thermique va se propager par conduction dans le catalyseur, puis par transfert externe à travers la couche-limite fluide autour du grain.
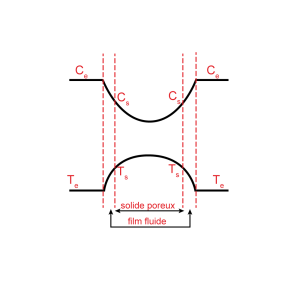
D'où les profils habituels de concentration et température suivants (pour le cas d'une réaction exothermique).
Notion fondamentale : Surface active du catalyseur
Dans le cas de la catalyse hétérogène, la surface active du catalyseur doit être la plus grande possible pour favoriser la réaction.
Exemple : Utilisation industrielle de catalyseurs solides
La synthèse de l'ammoniac \(NH_3\) est un exemple d'utilisation de la catalyse hétérogène dans un procédé industriel (procédé Haber-Bosch, des noms de ses inventeurs en 1910).
L'équation de la réaction est la suivante : \(N_2 \: + \: 3 \, H_2 \; \rightarrow \; 2 \, NH_3\)
On utilise un catalyseur solide à base de fer métallique \(Fe\), qui permet d'abaisser la température de travail (450°C). La synthèse est réalisée sous 250 bar.
On peut également citer comme exemple les pot catalytiques des automobiles, dont le catalyseur (à base de palladium \(Pd\), platine \(Pt\) et rhodium \(Rh\)) permet la réduction ou l'oxydation des gaz nocifs (\(CO\) et \(NO_x\) notamment) issus de la combustion incomplète dans le moteur en composés inoffensifs (\(H_2O\), \(CO_2\), \(N_2\)).