Réaction autocatalytique : optimisation de la conversion
L'étude cinétique de l'action de l'oxyde de propylène sur le thioglycol propylénique en phase aqueuse a montré que cette réaction était d'ordre 1 par rapport à l'époxyde (A), d'ordre zéro par rapport au Mercaptan (B) et qu'elle était catalysée (ordre 1) par le thiodiglycol (C) formé. À 20°C, la constante de vitesse vaut 8,17 10-4 m3 kmol-1 s-1. La réaction est la suivante :
C3H6O + HS-C3H6OH \(\xrightarrow{H_2O}\) S-(C3H6OH)2
que l'on notera simplement : A +B → C
On veut traiter un débit d'alimentation Qv0 = 1,40 10-3 m3 s-1 et obtenir un taux de conversion final de A égal à 90%. La température du mélange réactionnel est maintenue à 20°C. La composition de l'alimentation est la suivante : CA0 = a = 0,99 kmol m-3 ; CB0 = b = 0,90 kmol m-3 ; CC0 = c = 0,033 kmol m-3.
Question
Calculer le volume nécessaire pour atteindre le taux de conversion final fixé dans le cas d'un réacteur parfaitement agité continu.
Résultat
16,7 m3
Solution
Le taux de conversion de A est tel que : \(F_A = F_{A0} \cdot \left( 1 - X_A \right)\), avec \(F_{A0} = a \cdot Q_v\). Si on considère que le débit volumique est constant, cela revient à : \(C_A = \frac{F_A}{Q_v} = a \cdot \left( 1 - X_A \right)\).
A | + B | → C | |
à l'entrée du réacteur : | \(a \cdot Q_v\) | \(b \cdot Q_v\) | \(c \cdot Q_v\) |
n'importe où dans réacteur : | \(a \cdot Q_v \cdot \left( 1 - X_A \right)\) | \(Q_v \cdot \left( b - a \cdot X_A \right)\) | \(Q_v \cdot \left( c + a \cdot X_A \right)\) |
Et on a \(C_B = \frac{F_B}{Q_v} = b - a \cdot X_A\) et \(C_C = \frac{F_C}{Q_v} = c + a \cdot X_A\). Le vitesse de la réaction est donc : \(r = k \cdot a \cdot \left(1 - X_A \right) \cdot \left(c + a \cdot X_A \right)\)
Le bilan en A dans un RPA s'écrit : \(F_{A0} - r \cdot V_{RPA} = F_A\), soit \(a \cdot Q_v - k \cdot a \cdot \left( 1 - X_A^s \right) \cdot \left( c + a \cdot X_A \right) \cdot V_{RPA} = Q_v \cdot a \cdot \left( 1 - X_A^s \right)\).
D'où \(V_{RPA} = \frac{Q_v}{k} \cdot \frac{a \cdot X_A^s}{a \cdot \left( 1 - X_A^s \right) \cdot \left( c + a \cdot X_A^s \right)} =\)16,7 m3 (pour \(X_A^s =\)0,90)
Question
Même question dans le cas d'un réacteur tubulaire (à écoulement piston).
Résultat
9,4 m3
Solution
Le bilan en A dans un réacteur piston s'écrit : \(\mathrm{d}F_A = -r \cdot \mathrm{d}V\)
Soit \(-Q_v \cdot a \cdot \mathrm{d}X_A = - k \cdot a \cdot \left( 1 - X_A \right) \cdot \left( c + a \cdot X_A \right) \cdot \mathrm{d}V\), ou encore \(\mathrm{d}V = \frac{Q_v}{k} \cdot \frac{\mathrm{d}X_A}{\left( 1 - X_A \right) \cdot \left( c + a \cdot X_A \right)}\)
On décompose cette fraction : \(\frac{1}{\left( 1 - X_A \right) \cdot \left( c + a \cdot X_A \right)} = \frac{\alpha}{1 - X_A} + \frac{\beta}{c + a \cdot X_A}\). Pour retrouver les valeurs de \(\alpha\) et \(\beta\), on remet tout sur le même dénominateur : \(\frac{\alpha \cdot c + \alpha \cdot a \cdot X_A + \beta - \beta \cdot X_A}{\left( 1 - X_A \right) \cdot \left( c + a \cdot X_A \right)}\). Il faut donc que \(\alpha \cdot a - \beta = 0\), donc \(\beta = \alpha \cdot a\) et que \(\alpha \cdot c + \beta = 1\), soit \(\alpha \cdot c + \alpha \cdot a = 1\) ; d'où \(\alpha =\frac{1}{a+c}\) et \(\beta =\frac{a}{a+c}\)
Donc \(\mathrm{d}V = \frac{Q_v}{k} \cdot \frac{1}{a+c} \cdot \left[ \frac{\mathrm{d}X_A}{1 - X_A} + a \cdot \frac{\mathrm{d}X_A}{c + a \cdot X_A} \right]\)
D'où \(V_{piston} = \frac{Q_v}{k} \cdot \frac{1}{a+c} \cdot \left[ \int\limits_{0}^{X_A^s}{\frac{\mathrm{d}X_A}{1 - X_A}} + a \cdot \int\limits_{0}^{X_A^s}{\frac{\mathrm{d}X_A}{c + a \cdot X_A}} \right] = \frac{Q_v}{k} \cdot \frac{1}{a+c} \cdot \left[ -\ln \ \left( 1 - X_A^s \right) + \frac{a}{a} \cdot \ln \ \frac{c + a \cdot X_A^s}{c} \right]\)
Finalement \(V_{piston} = \frac{Q_v}{k} \cdot \frac{1}{a+c} \cdot \ln \ \left( \frac{1 + \frac{a}{c} \cdot X_A^s}{1 - X_A^s} \right) =\)9,4 m3 (toujours pour \(X_A^s =\) 0,90)
Question
On envisage un montage associant un réacteur agité continu (RAC) et un réacteur tubulaire (TUB). Comment réaliser le montage afin que le volume global \(V_{RAC} + V_{TUB}\) soit le plus faible possible ? Calculer les volumes \(V_{RAC}\) et \(V_{TUB}\) correspondants. Commenter.
Résultat
RAC de 3,1 m3 jusqu'à la conversion de 48,3% puis TUB de 3,8 m3 jusqu'à la conversion de 90%
Solution
Traçons \(\frac{C_{A0}}{r} = \frac{a}{k \cdot a \cdot \left( 1- X_A \right) \cdot \left( c + a \cdot X_A \right)} = \frac{1}{k \cdot \left( 1- X_A \right) \cdot \left( c + a \cdot X_A \right)}\) vs \(X_A\) :
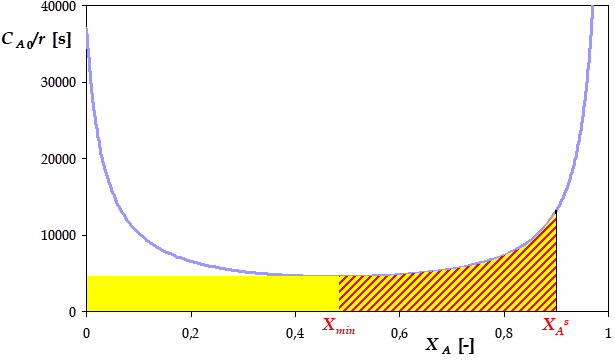
L'optimum consiste à associer un RPA puis en réacteur piston en série. Le RPA (aire colorée en jaune ci-dessus) doit conduire au taux de conversion \(X_A^{min}\), puis le réacteur piston (aire hachurée de rouge) jusqu'au taux de conversion souhaité \(X_A^s\).
Pour calculer \(X_A^{min}\), on dérive \(\frac{C_{A0}}{r}\) par rapport à \(X_A\) :
\(\frac{\mathrm{d}{C_{A0}}/{r}}{\mathrm{d}X_A} = - \frac{1}{k} \cdot \frac{\frac{\mathrm{d}\left( \left( 1 - X_A \right) \cdot \left( c + a \cdot X_A \right) \right)}{\mathrm{d}X_A}}{\left( 1 - X_A \right)^2 \cdot \left( c + a \cdot X_A \right)^2} = - \frac{1}{k} \cdot \frac{a \cdot \left( 1 - X_A \right) - \left( c + a \cdot X_A \right)}{\left( 1 - X_A \right)^2 \cdot \left( c + a \cdot X_A \right)^2} = - \frac{1}{k} \cdot \frac{a - c - 2 \cdot a \cdot X_A}{\left( 1 - X_A \right)^2 \cdot \left( c + a \cdot X_A \right)^2}\)
Cette dérivé s'annule lorsque le nominateur \(a - c - 2 \cdot a \cdot X_A\) est nul, soit pour \(X_A^{min} = \frac{a-c}{2 \cdot a} =\) 48,3%
On peut alors calculer le volume du premier réacteur à partir de l'expression établie précédemment pour le réacteur parfaitement agité, mais en allant seulement jusqu'à un taux de conversion \(X_A^{min}\) :\(V_{RAC} = \frac{Q_v}{k} \cdot \frac{a \cdot X_A^{min}}{a \cdot \left( 1 - X_A^{min} \right) \cdot \left( c + a \cdot X_A^{min} \right)} =\) 3,1 m3
Pour le second réacteur, il faut reprendre l'intégration entre \(X_A^{min}\) et \(X_A^s\) : \(V_{TUB} = \frac{Q_v}{k} \cdot \frac{1}{a+c} \cdot \left[ \ln \ \left( \frac{c + a \cdot X_A^s}{c + a \cdot X_A^{min}} \right) - \ln \ \left( \frac{1-X_A^s}{1-X_A^{min}} \right) \right] =\) 3,8 m3
Soit 6,9 m3 au total pour les deux réacteurs.
Le gain par rapport au volume du réacteur piston pur n'est pas énorme. Il n'est pas sûr qu'il soit dans ce cas pertinent de construire deux réacteurs, même s'ils ont un volume global inférieur... Une évaluation économique serait nécessaire pour avoir une réponse définitive sur cet optimisation.
Question
Reprise de toutes les questions en vidéo.
Solution en vidéo
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.