Notions de tension de surface et de mouillabilité
Cette partie est proposée pour ceux qui voudraient aller plus loin ; elle n'est pas indispensable à la suite de ce module.
Tension de surface
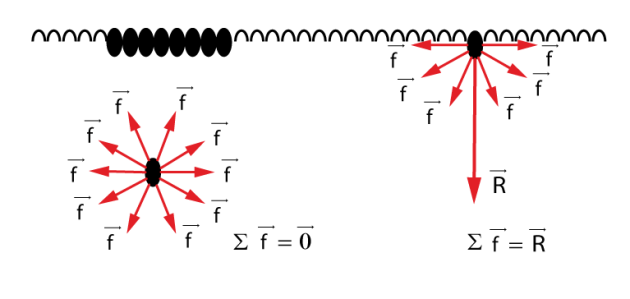
La tension de surface (ou tension superficielle) caractérise le contact entre deux fluides, généralement un liquide et un gaz. Une molécule dans un liquide immobile est soumise aux forces d'attraction de ses proches voisines. Si cette molécule est située au sein du liquide, la résultante de ces forces est nulle. Mais si cette molécule est située en surface du liquide, la résultante est une force dirigée vers l'intérieur du liquide.
Définition : Coefficient de tension superficielle
Ceci explique pourquoi les liquides ont tendance à minimiser leur surface ; ainsi les gouttes sont sphériques, car la sphère présente le plus faible rapport surface / volume. Le travail \(dW\) nécessaire pour une augmentation \(dS\) de la surface libre du liquide est tel que \(dW=\sigma \cdot dS\). Le coefficient de proportionnalité \(\sigma\)[2] est appelé coefficient de tension superficielle, ou simplement tension superficielle ou encore tension de surface. C'est aussi le coefficient de proportionnalité entre l'énergie dépensée pour créer de la surface et la surface créée.
La tension de surface a pour équation aux dimensions M T-2, et est généralement exprimé en N m-1.
Exemple : Ordres de grandeur de la tension de surface
On peut donner quelques ordres de grandeur de tension de surface à 20 °C : 0,07 N m-1 pour le système air-eau ; 0,03 N m-1 pour le système air-benzène ; 0,5 N m-1 pour le système air-mercure ; 0,04 N m-1 pour le système eau-benzène ; 0,4 N m-1 pour le système eau-mercure.
Notion fondamentale : Surpression dans une goutte
À l'intérieur d'une goutte, il règne une surpression telle que \(P_{interne}=P_{externe}+2\cdot \frac{\sigma }{R}\), où \(R\) est le rayon de courbure de la goutte. À l'équilibre, cette surpression est compensée par la tension superficielle.
Ainsi dans une goutte d'eau de 1 cm de diamètre, la différence de pression entre l'intérieur et l'extérieur de la goutte est de 14 Pa ; ce qui est plus de 7000 fois moins que la pression atmosphérique ordinaire (101325 Pa).
Dans la pratique, cette surpression est donc complètement négligeable dans la plupart des cas.
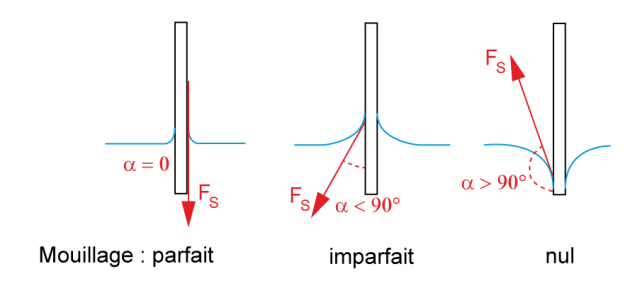
Définition : Angle de raccordement et mouillabilité
Si l'on dépose une goutte d'eau sur une lame de verre, cette goutte s'étale plus ou moins selon l'état de propreté de la lame, comme illustré ici. On appelle angle de raccordement, l'angle \(\alpha\)[3] formé entre la surface solide et la force de tension superficielle (qui est perpendiculaire à la ligne de contact entre le liquide et le solide et tangente à la surface liquide).

Cet angle de raccordement caractérise la propriété de mouillabilité du solide par le liquide : plus \(\alpha\) est petit, plus on dit que le liquide "mouille bien" le solide, comme le montre l'illustration ci-contre.
Ascension capillaire
Lorsqu'un un tube vertical de petit diamètre plonge dans un liquide qui mouille le matériau du tube ( \(\alpha\) < 90 °), on observe une ascension du liquide dans le tube, due au phénomène de capillarité. La hauteur d'ascension \(h\) est donnée par la relation : \(\rho \cdot g\cdot h=\frac{2\cdot \sigma \cdot \cos \,\alpha }{r}\) où \(r\) est le rayon du tube.
Notion fondamentale : Importance (ou non) des phénomènes capillaires
Les phénomènes capillaires ne deviennent importants que dans certains cas particuliers, tels que l'étude de la formation des gouttes et des bulles, ou encore de la mouillabilité des surfaces. Ils peuvent être négligés dans la plupart des problèmes d'écoulement de fluide, dès lors que l'on ne s'intéresse pas aux phénomènes de surface.